[报告速览]
过去十年:
-
全球生物制药行业每年在寻找新的治疗方法和药物方面的投入已经翻了一倍有余,其中 2023 年的投入达到 2620 亿美元。
-
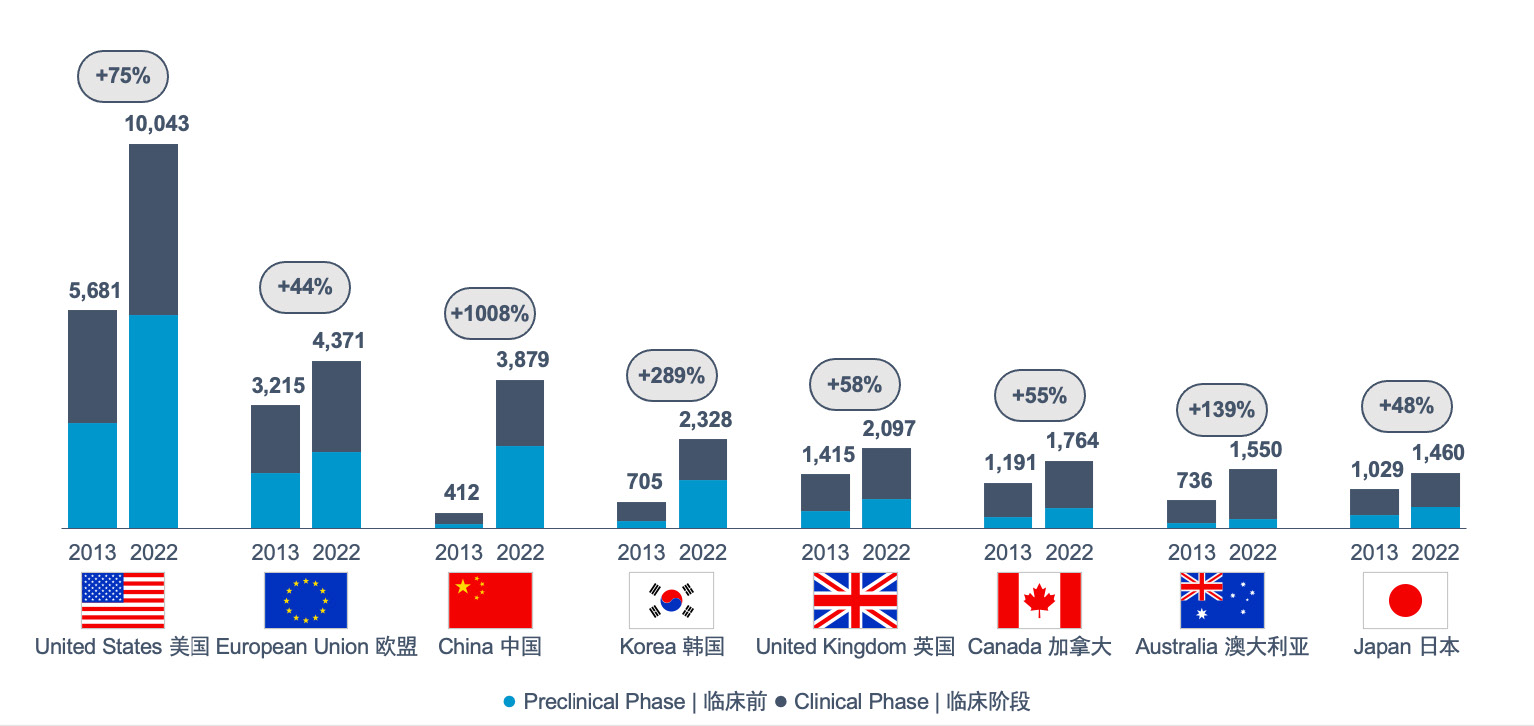
中国的研发管线取得了巨大的进展,处于临床前期和临床开发阶段的药物数量增长超过了 10 倍。预计在未来几年内,中国将以更快的速度批准更多的创新药物。
-
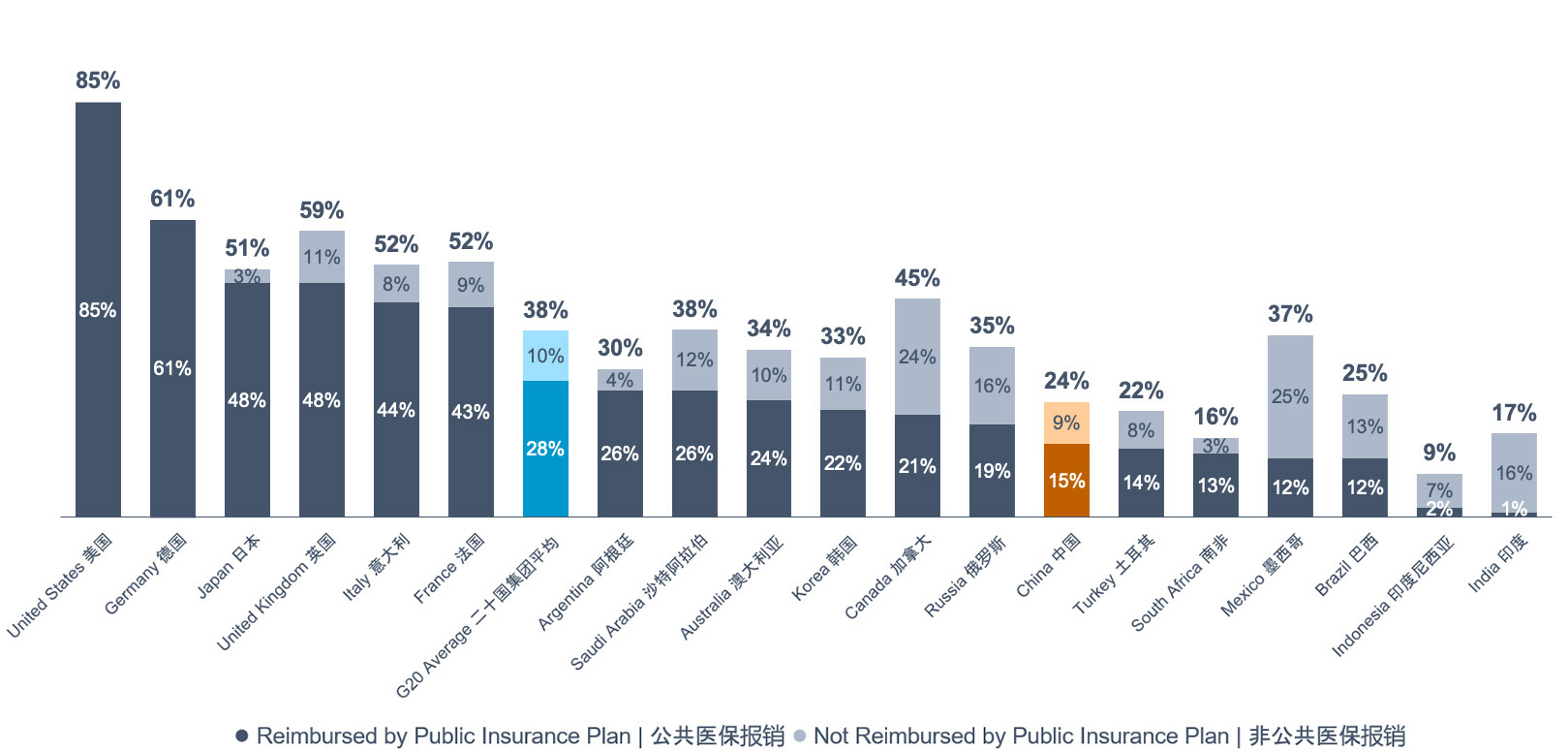
全球推出的新药中,在中国获批的百分比为24%,美国为 85%,经合组织国家平均为38%。此外,在中国的国家医保药品目录下,有 15%的全球新药能够获得报销。在提高患者的创新药物可及性方面,中国仍有很大发展空间。
人口老龄化、对更加健康状态的期望、对更长寿命的期待加速了中国对医疗保健服务的需求。
生物制药行业的持续增长需要支持性的政策环境,帮助患者获得创新药物,并激励对下⼀代治疗方法和药物的持续研究。
在药物研发和上市相关决策方面,创新生物制药公司会寻求稳定、可预测的支持创新的政策环境,包括:
-
保护创新的强有力的知识产权;
-
可预测的、基于科学的监管途径,确保及时市场准入;
-
奖励创新并为激励下一代药物投入提供可能性的支付体系。
——
2024年3月24日-25日,PhRMA应邀出席2024中国发展高层论坛,并向论坛提交了题为《生物制药创新:促进研发和患者药品可及性》的企业报告。
报告基于全球生物制药市场的数据和经验,展示了支持创新的公共政策与对创新药物更大投入和可及性之间的关系。
全球研发管线显著增长
生物制药公司在研发方面的大力投入正在带来前所未有的进步和发现。今天,全球正在临床开发的药物超过8,000种,以解决迫切的、未满足的医疗需求。
中国的研发管线取得了巨大的进展,在过去十年中,处于临床前和临床开发阶段的药物数量增长超过了10倍,目前在全球仅次于美国(见图1)。我们预计未来几年内,中国将以更快的速度批准更多的创新药物。
新药可及性仍需提升
最近的一项分析了72个不同市场的新药可及性和公共报销情况的研究显示,全球正在推出创纪录数量的新药,但大多数国家的患者,包括许多发达国家的患者,只能获得其中很小一部分。虽然在大多数的二十国集团国家,新药获批数量逐渐减少,但中国从2017年到2021年获批的新药数量翻了一番,成为二十国集团中改善最为显著的国家。
即便如此,过去10年在全球推出的新药中,在中国可获得的只有24%,而美国的这一比例为85%,二十国集团的国家平均为38%。此外,2012年至 2021年期间,中国的国家医保药品目录下可报销的全球推出之新药的比例仅为15%。因此,在提高患者的创新药物可及性方面,中国仍有很大潜力。
政策需求:支持创新、促进研发、提高药品可及性
将创新药物推入市场需要经历漫长、有风险且成本高昂的研发过程。平均而言,开发一种新药需要10到15年的时间,耗费26亿美元(约177亿元人民币)。成功的生物制药创新政策生态体系由三个核心组成部分构成,这三者密切相关,对于生物制药创新的增长和可持续性同等重要:
知识产权体系
健全的知识产权制度能够提供必要的激励措施,鼓励相关方投入大量资本和其他资源,研究、开发和推出创新药物,从而推动生物制药创新。
监管体系
一套有效的监管体系能够建立并始终将清晰的、基于科学的且公正的规则应用到产品的安全性、有效性和质量评估中,包括从临床前和临床开发到上市后监测和风险管理。成功的监管体系采用协调一致的指导方针,并在可能的情况下消除基于特定市场的要求。
定价和报销体系
定价和报销体系应当反映创新药物为患者和社会提供的整体价值,促使公司能够继续对下一代治疗方法和药物进行投入。此外,作为多层次医疗保障制度体系的一部分,商业健康保险提高了患者的药品可及性并降低了患者自付成本。
公共政策对研发投入以及患者药品可及性的影响
在市场开放、创新受到重视且知识产权得到保护和执法的地区,生物制药创新者拥有与合作伙伴合作、成功竞争及加速新药推出所需要的可预测性和确定性。相反,缺乏支持创新的政策,或者政策与创新相悖,则可能会对患者药品可及性以及研发投入造成阻碍。
监管数据保护
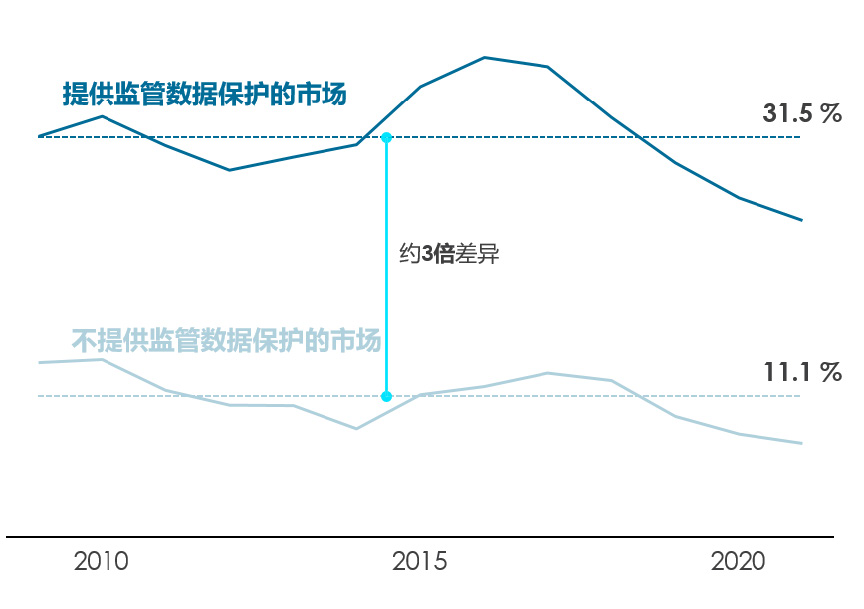
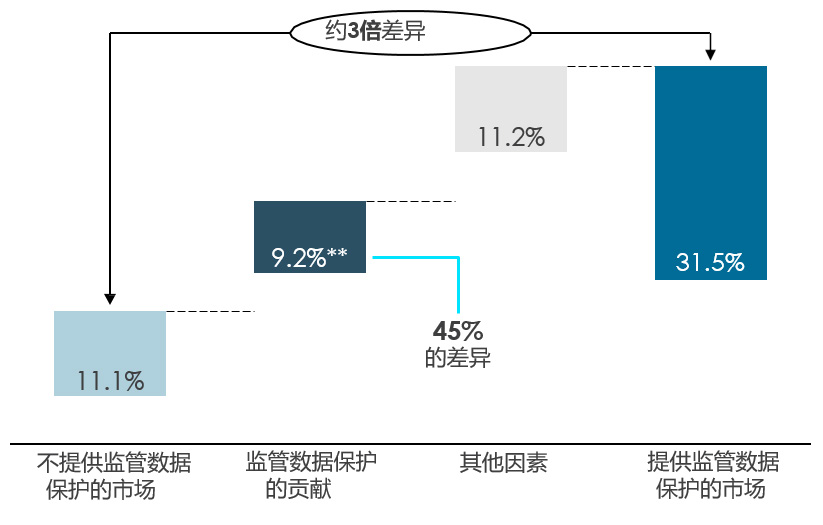
监管数据保护所提供的临床数据独占期为研发的投入和新药的推出提供了有力的激励。尤其是对于生物制品类无法被专利充分保护的药物,监管数据保护尤其重要。如图3和图4所示,提供监管数据保护的市场平均有31.5%的全球药物可供患者使用,而不提供监管数据保护的市场这一比例则为11.1%。在这一差异中,监管数据保护在药物可及性方面的贡献与其他因素相比高了9.2%,相当于该差异的45%。
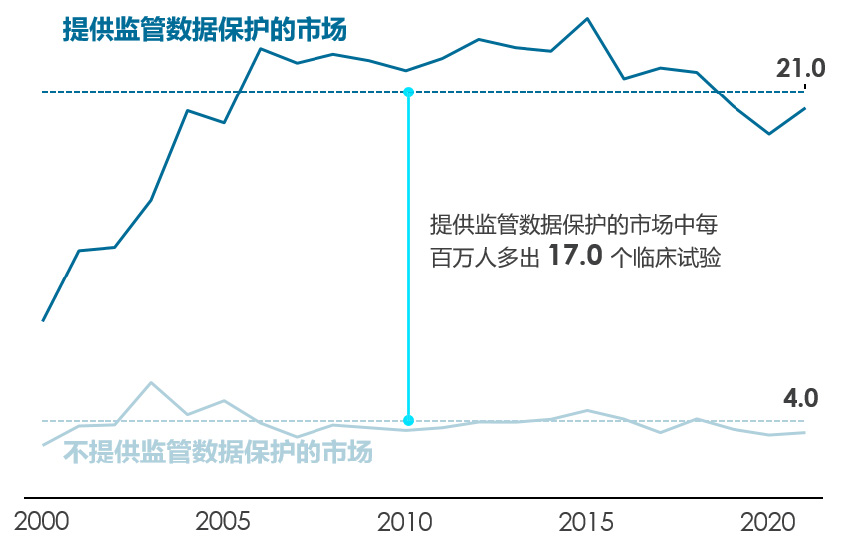
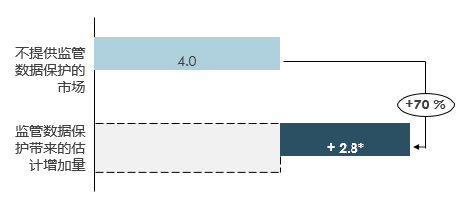
监管数据保护还与更多的临床试验活动相关。不提供监管数据保护的市场平均每百万人口有4个临床试验,而提供监管数据保护的市场平均每百万人口则有21个临床试验(图5)。对监管数据保护的孤立效应的评估显示,因为有监管数据保护,每百万人口临床试验增加2.8个(图6)。这相当于在不提供监管数据保护的市场的临床试验基线数量基础上,增加了70%。以日本和克罗地亚为例,两个国家的临床试验人数均在引入监管数据保护后增加,每百万人口分别增加了3.5和1.5个临床试验。
中国在加入世贸组织时已承诺提供监管数据保护。PhRMA建议有关方面迅速采取行动以践行此承诺,提供与国际最佳实践同等级的监管数据保护,进而提高国内生物制药行业的信心和可预测性。
定价和报销
创新者投资回报的确保需要及时、透明、与有依据的定价和报销体系。
体系中应含有透明度和正当程序、价值评估、定价和报销以及灵活性。只有当创新得到充分的回报时,创新者才能投资于下一代治疗手段和方法的开发和推出。另一方面,限制性定价报销政策可能会对研发和患者获取药品产生负面影响。
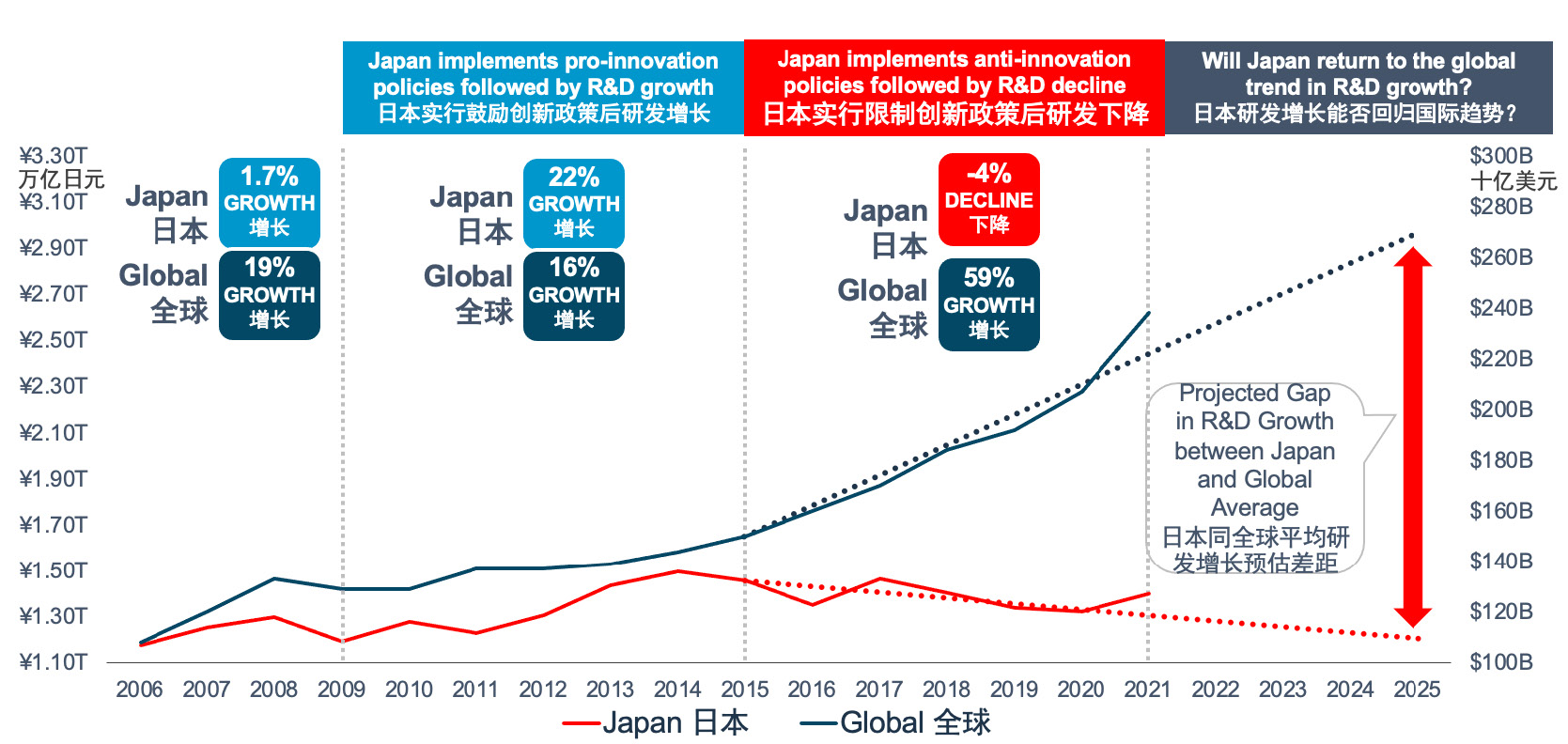
例如,2009-2015年,日本的医药产业在改革政策更加透明后减少了“药物滞后”的延迟,增长显著。而在2016年政府强制降价后,研发投资明显下降,因而日本政府也在2023年决定重新实施变革(图7)。
PhRMA建议,在中国加强医疗保健体系巨大进展的基础上,进一步建立基于价值的、更加透明的定价和报销体系,帮助中国患者更易获得最新的治疗方法,鼓励创新。
商业健康保险监管数据保护
除了公共定价和报销制度外,包括商业健康保险在内的多层次医疗保障体系有可能增加患者获得创新药物的机会并减少自付费用。在中国,自2015年推出至2022年12月,城市商业补充健康保险(“商业补充险”)计划已成为⼀项受欢迎的商业健康保险产品,受到政府、保险业和医药行业的关注,累计保费规模约人民币320亿元,总参保人次已达2.98 亿。尽管如此,商业补充险对于创新药物的覆盖范围仍然有限。平均而言,商业补充险的报销清单仅涵盖20个创新药品牌,涉及19种疾病。
从2018年起,珠海市启动了珠海市商业补充险项目,该项目的癌症筛查服务已通过早期检测成功节省了约990万元人民币的医疗费用,并有望为公众提供原本难以获得的创新药物。
作为一项健康保险,珠海的商业补充险旨在提供广泛的承保范围、相对较低的保费以及高赔付率。此外,珠海的商业补充险还为确诊患有重大疾病的患者提供一次性支付的重大疾病保险福利。该计划还涵盖筛查等健康管理服务,并与生物制药公司合作开展创新药物的患者援助计划,以提高低收入患者的药品可及性。
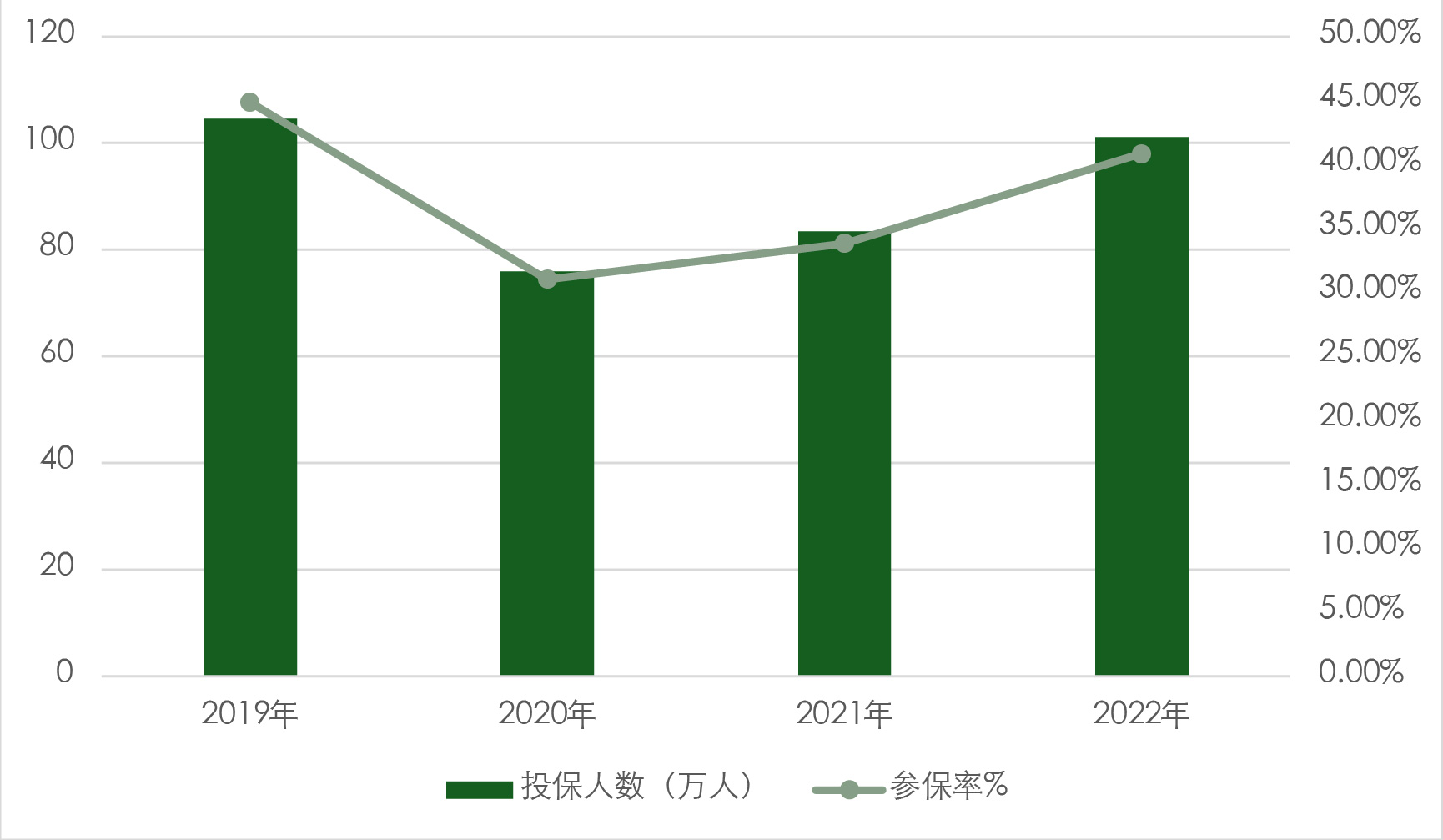
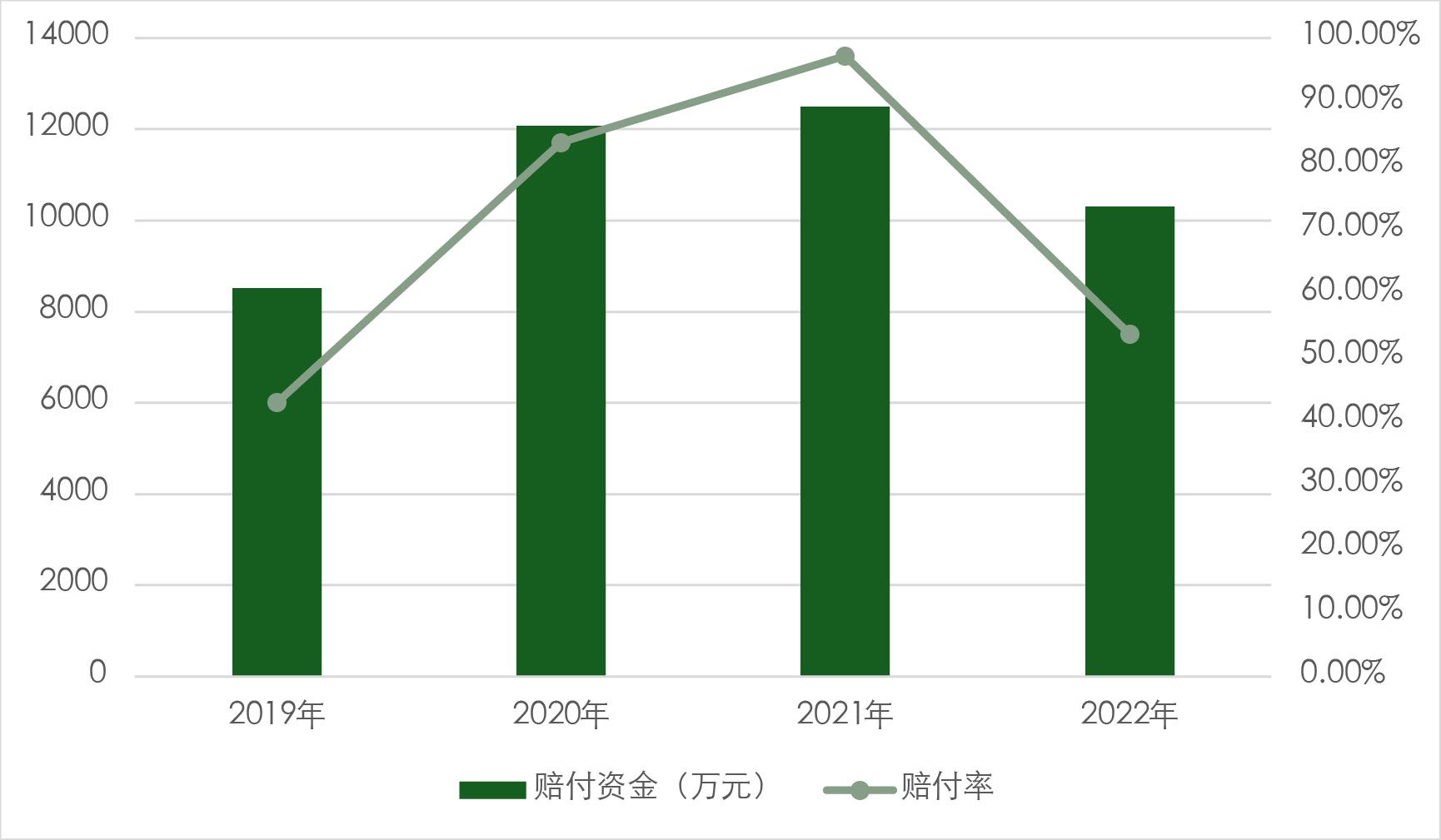
截至2023年,该项目参保人数达到约110万人,位居广东省第一、全国前列。自成立以来,投保人覆盖率一直在35%-45%之间,自2020年以来稳步上升(图8)。保费保持稳定,保费资金池持续扩大。
由珠海案例可以看出,在政府大力支持和推动下,商业补充险计划有可能为公众提供本来难以获得的创新药物。
PhRMA建议政府在现有进展基础上,进一步改善政策环境,扩大患者获得创新药物的机会,让商业补充险得到可持续发展。
——
结语
生物制药创新的进展正在彻底改变疾病的诊断、治疗、治愈和预防,患者的生命因而得以挽救,各种慢性病和罕见病患者的生活质量因此得以改善。
在新的医学时代,许多曾被认为是致命的疾病如今都已变得可控并有可能治愈。在恰当的政策环境下,生物制药创新可以充分发挥潜力,让中国和世界各地的患者享受更健康、更长寿的生活。
了解更多PhRMA政策建议以及报告相关信息,请点击查看《生物制药创新:促进研发和患者药品可及性》全文。